सर्व जैव रसायनांचा मुख्य घटक कार्बन असतो; म्हणून त्यांना कार्बनी संयुगे व त्यांच्यासंबंधीच्या शास्त्रास कार्बनी रसायनशास्त्र व उरलेल्या सर्व रसायनांविषयीच्या शास्त्रास अकार्बनी रसायनशास्त्र या संज्ञा वापरात आल्या.
कार्बन (carbon) व हायड्रोजन (hydrogen) या मूलद्रव्यांचा बंध नसलेल्या संयुगांचे संश्लेषण, गुणधर्म व उपयोग यांच्या अभ्यासाला अकार्बनी रसायनशास्त्र म्हणता येईल. या शाखेत कार्बनी-धातु (organometallic) गटातील संयुगे येतात. ज्यांच्यात कार्बन हा घटक C-H या बंधाच्या स्वरूपात नाही अशा सर्व द्रव्यांचा विचार अकार्बनी रसायनशास्त्रात केला जातो. कार्बन असणाऱ्या काही संयुगांचा उदा., कार्बोनेटे, सायनाइडे व कार्बन डायऑक्साइडासारखी काही संयुगे यांचा समावेश अकार्बनी रसायनशास्त्रात केला जातो.
वर्गीकरण : अकार्बनी रसायनशास्त्रामध्ये अभ्यासल्या जाणाऱ्या संयुगांचे अम्ल, आम्लारी, क्षार आणि ऑक्साइडे असे ढोबळ वर्गीकरण करता येते.
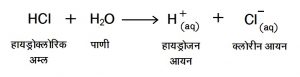 (१) अम्ल : अम्लाचे जलीय विघटन होऊन हायड्रोजन आयन (H+) तयार होतात.
(१) अम्ल : अम्लाचे जलीय विघटन होऊन हायड्रोजन आयन (H+) तयार होतात.
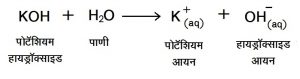 (२) आम्लारी : आम्लारीचे जलीय विघटन होऊन हायड्रॉक्साइड आयन (OH–) तयार होतात.
(२) आम्लारी : आम्लारीचे जलीय विघटन होऊन हायड्रॉक्साइड आयन (OH–) तयार होतात.
(३) क्षार : अम्ल व आम्लारी यांमध्ये विक्रिया होऊन क्षार तयार होतात.
(४) ऑक्साइडे : ऑक्साइडांमध्ये ऑक्सिजन अणूचा समावेश असतो. उदा., सोडियम ऑक्साइड (NaO).
विक्रिया प्रकार :
 (१) संयोग विक्रिया (combination reaction) : दोन विक्रियाकारकांचा संयोग होऊन एक उत्पादक तयार होते. उदा.,
(१) संयोग विक्रिया (combination reaction) : दोन विक्रियाकारकांचा संयोग होऊन एक उत्पादक तयार होते. उदा.,
(२) अपघटन विक्रिया (decomposition reaction) : एका विक्रियाकारकाचे दोन उत्पादकांमध्ये रूपांतर होते. उदा.,
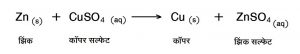 (३) विस्थापन विक्रिया (single displacement reaction) : या विक्रियेमध्ये एक अणू किंवा मूलद्रव्य दुसऱ्या अणू किंवा मूलद्रव्याच्या जागी स्थापित होते. उदा.,
(३) विस्थापन विक्रिया (single displacement reaction) : या विक्रियेमध्ये एक अणू किंवा मूलद्रव्य दुसऱ्या अणू किंवा मूलद्रव्याच्या जागी स्थापित होते. उदा.,
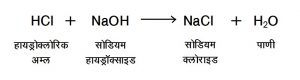
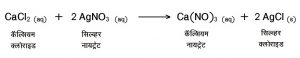
(४) द्विविस्थापन विक्रिया (double displacement) : दोन भिन्न संयुगे एकमेकांना विस्थापित करून दोन नवीन संयुगांची निर्मिती करतात. उदा.,
उपयुक्तता : आयनिक संयुगांपैकी सोडियम क्लोराइड (NaCl), पोटॅशियम क्लोराइड (KCl), कॅल्शियम कार्बोनेट (CaCO3), सोडियम बायकार्बोनेट (NaHCO3) ही काही महत्त्वाची संयुगे होत. तसेच भूरसायनशास्त्रामध्ये भूस्तरामधील विविध मूलद्रव्यांचा अभ्यास करताना आणि औद्योगिक उत्पादनामध्ये अकार्बनी रसायनशास्त्राचा उपयोग केला जातो.
समीक्षक – श्रीनिवास सामंत