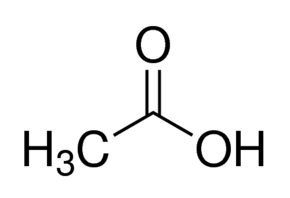
भौतिक गुणधर्म : एक कार्बनी अम्ल. सूत्र CH3·COOH. इतर नावे अथॅनॉइक अम्ल, एथॅनॉलाचे अम्ल. स्वच्छ, वर्णहीन व द्रवरूप असते. याला तिखट वास असतो. वि.गु. १·०५५, वितळबिंदू १६·७० से., उकळबिंदू ११०० से. उकळबिंदूच्या जवळपास तापमान असताना ते ज्वालाग्राही असून त्याची ज्योत निळसर व मंद प्रकाश देणारी असते. थंड करून गोठविल्यावर १६·५० से. ला त्याचे बर्फाच्या स्फटिकासारखे स्फटिक होतात, म्हणून त्याला संहत किंवा ग्लेशियल ॲसिटिक अम्ल असेही म्हणतात.
ॲसिटिक अम्ल हे पाण्यात, अल्कोहॉलात व ईथरात कोणत्याही प्रमाणात मिसळते. त्याच्यात गंधक, फॉस्फरस व कित्येक कार्बनी संयुगे विरघळू शकतात.
रासायनिक विक्रिया : सक्रिय, म्हणजे मूलद्रव्यांच्या विद्युत् वर्चस् (विद्युत् स्थिती) मालेतील, हायड्रोजनाच्या वरचे स्थान असणाऱ्या धातूंवर ॲसिटिक अम्लाची विक्रिया होऊन त्या धातूंचे ॲसिटेट (उदा., सोडियम ॲसिटेट) तयार होते व हायड्रोजन विमुक्त होतो.
काही ऑक्साइडांवर त्याची विक्रिया होऊन (उदा., शिशाचे ॲसिटेट) किंवा काही सल्फाइडांवर विक्रिया होऊन ॲसिटेटे (उदा., जस्ताचे ॲसिटेट, मँगॅनीज ॲसिटेट) तयार होतात. अल्कोहॉलांची या अम्लाशी विक्रिया होऊन एस्टरे (ॲसिटेटे) तयार होतात. ॲसिटिक अम्ल व फॉस्फरस ट्रायक्लोराइड किंवा थायोनील क्लोराइड (SOCl3) यांच्या विक्रियेने ॲसिटिल क्लोराइड तयार होते.
ॲसिटिक क्लोराइडाचा उपयोग करून कार्बनी संयुगांचे ॲसिटिलीकरण केले जाते. ॲसिटिक अम्लाचे निर्जलीकरण करून (रेणूतील H व OH हे पाण्याचे घटक काढून टाकून) ॲसिटिक ॲनहायड्राइड मिळते व ॲसिटिलीकरणासाठी त्याचाही उपयोग होतो.
प्राप्ती : (१) लाकडाचे भंजक ऊर्ध्वपातन (उष्णतेने पदार्थातील घटकांचे तुकडे होऊन तयार झालेली संयुगे वेगळी करण्याची क्रिया) करताना लोखंडी हवाबंद बकपात्रात घातलेले लाकूड २५०० से. पेक्षा अधिक तापमानात तापविल्यावर त्याच्यापासून लोणारी कोळसा, वाफ व अनेक वायू तयार होतात. ऊर्ध्वपातनाने मिळालेले वायू थंड केल्यावर मिळणाऱ्या द्रवास ‘पायरोलिग्नीयस अम्ल’ म्हणतात. तो तसाच राहू दिल्यावर त्याच्या तळाशी भारी थर व वरचा हलका तपकिरी जलीय थर असे दोन थर होतात. वरच्या थरात मुख्यतः ॲसिटिक अम्ल, मिथिल अल्कोहॉल, ॲसिटोन व इतर कार्बनी संयुगे असतात. वरच्या जलीय थराच्या द्रवाचे तांब्याच्या बकपात्रात ऊर्ध्वपातन करून मिळणारे वायू चुन्याच्या निवळीतून (कॅल्शियम हायड्रॉक्साइडामधून) जाऊ दिले म्हणजे त्यांच्यातील ॲसिटिक अम्ल, कॅल्शियम ॲसिटेटाच्या (ग्रे ॲसिटेट ऑफ लाइम) स्वरूपात अवक्षेपित होते (साका बनतो) व इतर संयुगे बाहेर जाणाऱ्या वायूबरोबर निघून जातात. संहत सल्फ्यूरिक अम्लाबरोबर कॅल्शियम ॲसिटेटाचे निर्वात ऊर्ध्वपातन करून अत्यंत संहत ॲसिटिक अम्ल मिळविले जाते. ॲसिटिक अम्ल तयार करण्याची ही पद्धत फार जुनी आहे, पण अद्यापिही काही थोड्या ठिकाणी ती वापरली जाते.
(२) एथिल अल्कोहॉलाच्या विरल विद्रावात, पोषक अशी द्रव्ये असली, तर ॲसिटोबॅक्टर इ. सूक्ष्मजंतूंच्या क्रियेमुळे एथिल अल्कोहॉलाचे ॲसिटिक अम्ल तयार होते, परंतु त्याचे प्रमाण ५% पेक्षा अधिक नसते. अल्कोहॉलाचा विद्राव अगदी विरल असला, तर ८% ॲसिटिक अम्ल तयार होते. या पद्धतीत काही सुधारणा केल्या गेल्या आहेत. त्यामुळे ॲसिटिक अम्ल लवकर तयार होते व त्याचे व्यापारी उत्पादन करणे शक्य होते. सु. ३·२५ मी, व्यास व ५ मी. उंची असलेल्या लाकडी पिपात लाकडाचा सालपा किंवा कोळसा गाळून त्याच्यावर सु. १५% अल्कोहॉल असलेला विद्राव व सूक्ष्मजंतूंना पोषक असे शर्करा, फॉस्फरस व नायट्रोजन असलेल्या द्रव्यांचे विद्राव घालतात. पिपात तळाकडून वर कोमट हवा सोडण्याची व्यवस्था असते. पिपातील मसाल्याचे तापमान ३०० ते ३५० से. इतके राखले जाते. या पद्धती ॲसिटिक अम्ल लवकर तयार होते परंतु त्याचे प्रमाण १०% पेक्षा अधिक नसते. त्यापेक्षा अम्लाचे प्रमाण अधिक झाल्यास सूक्ष्मजंतू मरतात. शिर्क्याचे औद्योगिक उत्पादन करण्यासाठी ही पद्धती वापरतात.
शिर्का हा पदार्थ फार प्राचीन काळापासून, सु. पाच हजार वर्षांपूर्वीपासून, मानवाच्या उपयोगात आहे. परंतु एकोणिसाव्या शतकाच्या उत्तरार्धातच लाकडाचे भंजक ऊर्ध्वपातन करून ॲसिटिक अम्लाच्या उत्पादनास आरंभ झाला. ही पद्धती अजूनही क्वचित वापरली जाते.
ॲसिटिक अम्लाचे व्यापारी उत्पादन मुख्यतः संश्लेषणाने (घटक अणू अथवा रेणू एकत्र आणून कृत्रिम रीतीने) केले जाते. या पद्धती ॲसिटोनाचे ॲसिटाल्डिहाइड बनवितात व त्याच्यापासून ॲसिटिक अम्ल बनवितात. ते संहत असून सापेक्षतः बरेच शुद्ध असते व अधिक स्वस्तही पडते.
उपयोग : (१) शिर्क्यात (व्हिनेगारामध्ये) ३% ते ५% ॲसिटिक अम्ल असते. पदार्थाना आंबट चव येण्याकरता तसेच पदार्थ टिकाऊ राहावेत म्हणून त्याचा उपयोग केला जातो. (२) ॲसिटिक अम्लाच्या एकूण उत्पादनापैकी बराचसा भाग ॲसिटिक ॲनहायड्राइड, ॲसिटिक रेयॉन व इतर कृत्रिम धागे यांच्या उत्पादनासाठी लागणारे सेल्युलोज ॲसिटेट तयार करण्यासाठी खर्ची पडतो. (३) ॲसिटिक अम्ल व अल्कोहॉले यांच्या विक्रियेने बनविलेल्या मिथिल, एथिल, प्रोपिल व ब्युटिल ॲसिटोटांचा उपयोग रंगलेपांच्या व व्हार्निशांच्या उत्पादनात विद्रावक (विरघळविणारा पदार्थ) म्हणून मोठ्या प्रमाणात होतो. (४) लॅकर रंगांसाठी व चलच्चित्रपटाच्या फिल्मांसाठी सेल्युलोज ॲसिटेट वापरले जाते. नैसर्गिक रबरावर संस्कार करण्यासाठी, कृत्रिम चामडे करण्यासाठी, गंधक, फॉस्फरस व अनेक कार्बनी संयुगे यांचा विद्रावक म्हणून, अनेक कार्बनी संयुगे बनविण्यासाठी तसेच कित्येक औषधांच्या उत्पादनात त्याचा उपयोग केला जातो. (५) सोडियम ॲसिटेट हे विशेषतः रासायनिक उद्योगात मोठ्या प्रमाणात वापरले जाते. (६) लेड ॲसिटेट हा पदार्थ चवीला साखरेसारखा गोड लागतो. (७) कॉपर ॲसिटेट गडद निळ्या रंगाचे असते आणि त्याचा रंग म्हणूनच उपयोग केला जातो. (८) निळ्या रंगाच्या वेगळ्या छटा मिळण्यासाठी त्यातच ॲल्युमिनिअम ॲसिटेट घातले जाते. (९) पॅलेडियम ॲसिटेटचा उपयोग रासायनिक क्रियेतून संप्रेरक म्हणून केला जातो. (१०) ॲसिटिक अम्लाची क्लोरीन किंवा ब्रोमीन बरोबर क्रिया करून क्लोर – आणि ब्रोमो- ॲसिटिक अम्ल बनते. ह्यापैकी क्लोरॲसेटिक अम्ल ॲस्टाटिक अम्लाची रासायनिक क्षमता वाढविण्यासाठी वापरले जाते. ब्रोमोॲसिटिक अम्ल आणि त्यापासून बनलेले एथिल ब्रोमोॲसिटेट ह्यांचा उपयोग दुसऱ्या महायुद्धात अश्रुधूर (tear gas) म्हणून केला गेला होता.

संहत ॲसिटिक अम्ल : (Glacial acetic acid). बहुतेक सेंद्रिय द्रव पदार्थ हे त्यांच्या ऊर्ध्वपातनाने शुद्ध केले जातात. ॲसिटिक अम्ल मात्र ७ ते ८ से. पर्यंत थंड करून शुद्ध केले जाते. ह्या तापमानाला केवळ ॲसिटिक आम्लच घन रूपात जाते आणि त्यातील पाणी द्रवरूपच राहते. द्रव पाणी ओतून दिले की खूपशा प्रमाणात ॲसिटिक अम्ल शुद्ध स्वरूपात मिळते . ह्याच पद्धतीचा वारंवार उपयोग करून ॲसिटिक अम्लाची शुद्धता वाढविली जाते. अशा पद्धतीने शुद्ध केलेल्या ॲसिटिक अम्लाला संहत किंवा ग्लेशियल ॲसिटिक अम्ल म्हटले जाते.
साठवण व हाताळणी : संहत (प्रमाण जास्त असलेल्या) अम्लाने कातडीची आग होते व फोड येतात. संहत अम्ल त्वक्रक्तिमाकर (कातडीला लाली आणणारे) असून विरल (प्रमाण कमी असलेले) अम्ल स्वेदक (घाम आणणारे), मूत्रल (लघवी साफ करणारे) व कफोत्सारक (श्वसनमार्गात कफ जास्त सुटेल असे करणारे) असते.
संदर्भ :
- Fieser, L. F.: Fieser, M. Organic Chemistry, Bombay, 1962.
समीक्षक – भालचंद्र भणगे