कोणत्याही प्रकारची धातू आणि तिच्या परिसरातील घटक यांच्यामधील विद्युत, रासायनिक किंवा रासायनिक विक्रियेमुळे धातूची स्फटिकीय रचना ढासळून तिच्या गुणधर्मांवर होणारा अनिष्ट परिणाम. कारणे, परिणाम व प्रतिबंधक उपाय यादृष्टीने गंजण्याच्या क्रियेचे द्रवीय व वायवीय असे दोन वर्ग, परिसरातील घटकांनुसार मानता येतात. याच क्रियांना आर्द्रव शुष्क गंजणे असेही म्हणतात.
लोखंड व पोलाद या धातूसर्व देशांत फार मोठ्या प्रमाणावर वापरल्या जातात आणि दरवर्षी त्यांपैकी २ टक्केधातू गंजून नष्ट होते. लोखंडाप्रमाणेच बहुतेक इतर सर्व धातू ही काही प्रमाणात गंजतच असतात. धातूंच्या गंजण्यामुळे कोट्यावधी रू. फुकट जातात व असे नुकसान होऊ नये म्हणून केलेल्या उपायांसाठीही लाखो रू. खर्च होतात, त्यामुळे आजच्या यांत्रिक युगात गंजण्याच्या क्रियेची मूलभूत माहिती व त्यावरील प्रतिबंधक उपायांचा अभ्यास याला फार महत्त्व आले आहे.
विसाव्या शतकाच्या मध्यापासून अणुभट्टीचा वापर आणि अवकाश यानांचे प्रयोग सुरू झाल्यापासून अतिउच्च तापमानावर प्रदीप्त झाली तरी आपले मूळ यांत्रिक गुणधर्म सोडणार नाही व कोणत्याही क्रियाशील लवणाच्या किंवा वायूच्या निकट सान्निध्यात राहूनही मुळीच गंजणार नाही अशी मिश्रधातू वा कृत्रिम पदार्थ तयार करणे, हा महत्त्वाचा प्रश्न तंत्रज्ञांपुढे आलेला आहे. अणुभट्टीच्या बाबतीत अतिउच्च तापमानाबरोबरच तीव्र किरणोत्सर्गाचाही (काही मूलद्रव्यांतून बाहेर पडणाऱ्या भेदक किरणांचाही) विचार करावा लागतो.
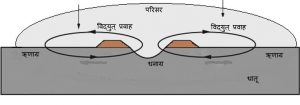
द्रवीय गंजणे: ही क्रिया म्हणजे धातू व तिचा परिसर यांमधील विद्यत् रासायनिक विक्रिया आहे. ही विक्रिया म्हणजे द्रवाने धातूवर केलेले आक्रमणच असते. ज्या ठिकाणी द्रवीय गंजणे चालू असते तेथे विद्युत् घटासारखी परिस्थिती उत्पन्न झालेली असते आणि एकदिश विद्युत् प्रवाह वाहत असतो. अशा विद्युत् घटामध्ये धातूच्या भागात एक धनाग्र व एक ऋणाग्र असते व परिसरातील द्रवातून वाहणाऱ्या विद्युत् रासायनिक गंजण्याची क्रिया होण्यासाठी आवश्यक असलेली परिस्थिती आ. १ मध्ये दाखविलेली आहे. सलग धातूमध्ये घनाग्र व ऋणाग्र उत्पन्न होण्यासाठी धातूमधील विषमता, दुसऱ्या धातूचा प्रत्यक्ष संबंध, दुसऱ्या धातूची मिसळ, धातूमध्ये उत्पन्न झालेले प्रतिबल (ताण किंवा संकोचन),धातूचे कण आणि त्यांच्या सीमारेषा, धातूचे स्फटिक आणि त्यांच्या सीमारेषांमधील प्रतिक्रिया अशी अनेक कारणे असू शकतात. द्रवीय गंजण्याच्या क्रियेत धनाग्र गंजते आणि ऋणाग्र अबाधित राहते. दोन धातू एकत्र आल्या, तर त्यांतील अधिक क्रियाशील धातू धनाग्र होते व दुसरी ऋणाग्र होते.
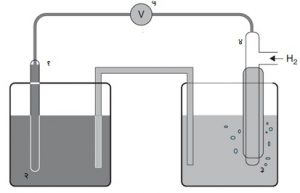
धातूंची क्रियाशीलता मोजताना प्रत्येक धातूच्या स्वत:च्या लवणाच्या विद्रावात विरघळण्याच्या प्रवृत्तीची हायड्रोजनाबरोबर तुलना करतात. त्यासाठी स्वत:च्या लवणाच्या विद्रावात बुडविलेली धातू सल्फ्यूरिक अम्लात बुडविलेल्या हायड्रोजन अग्राला जोडतात (आ. २). यामुळे जो विद्युत् दाब निर्माण होईल तो त्या धातूच्या क्रियाशीलतेचे माप समजतात. यालाच त्या धातूचे विद्युत् अग्र वर्चस असेही म्हणतात व ते व्होल्टमध्ये मोजतात.
दोन धातूंमधील प्रतिक्रिया मोजण्यासाठी त्या दोन धातूंमध्ये किती वर्चसांतर आहे ते पाहतात. संवाहक पाण्यात ठेवलेल्या निरनिराळ्या धातू आणि हायड्रोजन यांचे सापेक्ष विद्युत् वर्चस् दाखविण्यासाठी कोष्टक क्र. १ मध्ये रासायनिक श्रेणी दिली आहे. वरील श्रेणीतील दोन धातू एकत्र आल्या तर त्यांतील अधिक धन असलेली धातू गंजते. या श्रेणीमधील दोन धातूंमध्ये जितके जास्त अंतर असेल तितकी गंजण्याची क्रिया जास्त वेगाने होते. वरील श्रेणीत लोखंडापेक्षा जस्ताचे वर्चस् जास्त आहे व कथिलाचे वर्चस् कमी आहे. लोखंडाचे गंजणे रोखण्यासाठी त्याच्यावर जस्ताचा किंवा कथिलाचा मुलामा चढवितात.जस्ताचा मुलामा फाटला, तर गंजण्याची क्रिया जस्तावर होईल व लोखंड अबाधित राहील. परंतु कथिलाचा मुलामा फाटला, तर लोखंड झपाट्याने गंजेल.
कोष्टक क. १ निरनिराळ्या धातूवहायड्रोजन यांचे सापेक्ष विद्युत् वर्चस् :
| धातू | विद्युत् अग्र वर्चस् (व्होल्ट) | |||
| मॅग्नेशियम (Magnesium) | + २·३४ | वाढती | |
| | | | | | |
धनाग्रता |
| ॲल्युमिनियम (Aluminium) | + १·६७ | |||
| जस्त (Zinc) | +०·७६ | |||
| क्रोमियम (Cromium) | + o·७१ | |||
| लोखंड, पोलाद (Iron, Steel) | +o·४४ | |||
| कथिल (Tin) | +o·१४ | |||
| हायड्रोजन (Hydrogen) | ००० | वाढती | |
| | | |
ऋणाग्रता |
| तांबे (Copper) | -o·३४ | |||
| चांदी (Silver) | -o·८० | |||
| सोने (Gold) | – १·४२ | |||
वरील श्रेणीवरून सर्वसाधारण गंजण्याच्या क्रियेची दिशा समजसे,परंतु प्रत्यक्षात गंजण्याची क्रिया होत असताना तिचा वेग किती असेल, ते नीट समजत नाही. याचे मुख्य कारण म्हणजे गंजण्याची क्रिया चालू झाल्यावर धन आणि ऋण आयन तयार होऊन ते विद्रावात अग्रांच्या अगदी जवळच राहतात आणि ते धन व ऋण अग्रांवर उलटा विद्युत् दाब आणतात, त्यामुळे गंजण्याची क्रिया मंदावते. विद्रावातील धन आयन जर काही कारणामुळे बाहेर टाकले गेले किंवा नष्ट झाले, तर गंजण्याचा वेग पुन्हा वाढतो.
द्रवीय गंजण्याचे प्रकार : (अ) एकविध (सर्वत्र एकसारखे) गंजणे : या प्रकारात धातूचा सर्व पृष्ठभाग सारख्या प्रमाणात गंजतो. पुष्ठभागावरचा गंज खालच्या धातूपेक्षा कमी घन असेल, तर त्याचा थर पृष्ठभागावर घट्ट बसतो व त्यामुळे गंजण्याच्या क्रियेस विरोध होतो. उलटपक्षी हा गंज जर धातूपेक्षा अधिक घन असेल, तर पृष्ठ भागावरून सुटतो व गंजण्याची क्रिया अधिक जोराने होते.
धातूंचा बहुतेक नाश या प्रकारच्या गंजण्यामुळे होतो. मात्र या प्रकारच्या गंजण्यामुळे होणाऱ्या नाशाचा साध्या परीक्षणाने अंदाज करता येतो. याउलट स्थानिक स्वरूपाच्या गंजण्याच्या क्रियेचा अगोदर अंदाज घेता येत नाही व त्यामुळे अनपेक्षित दुर्घटना घडण्याची शक्यता उद्भवते.
(आ) खड्डे पडणे : काही वेळा धातूचा सर्व पृष्ठभाग सारख्या प्रमाणात गंजत नाही. गंजू लागलेल्या भागातील धनाग्राचा भाग एका मर्यादित जागेतच राहतो. त्यामुळे धातूचे गंजणे आजूबाजूला पसरत न जाता धातूच्या आत शिरते. सुरूवातीला उत्पन्न झालेल्या गंजाच्या खालच्या भागातून ऑक्सिजन नाहीसा होतो किंवा तेथे धातूच्या आयनांचे केंद्रीभवन वाढत जाते. परंतु गंजाच्या आजूबाजूच्या धातूमध्ये ऑक्सिजनाचे किंवा केंद्रित झालेल्या आयनांचे प्रमाण कायम राहते. गंजाच्या खाली उत्पन्न झालेल्या खड्ड्यात आयनांचे केंदीभवन वाढत जात असल्याने गंजाची खोलीही वेगाने वाढत जाते. या प्रकारच्या गंजण्याने सर्व धातूचा भाग झपाट्याने निकामी होतो.
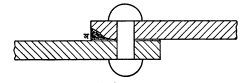
(इ) द्रवातील फरकामुळे गंजणे : ज्याप्रमाणे धातूमधील फरकामुळे धनाग्र व ऋणाग्र उत्पन्न होतात त्याचप्रमाणे द्रवातील फरकामुळेही धन व ऋण अग्रे उत्पन्न होतात. अशा द्रवामधील फरक हा त्यातील धातूच्याप्रमाणातील फरकामुळे अथवा त्यामध्ये विरघळलेल्या वायूच्या प्रमाणातील फरकामुळे उत्पन्न होतो. आ. ३ मध्ये दोन पोलादी पट्ट्यां चा रिव्हेट मारून केलेला जोड दाखविला आहे. अशा जोडामधील फटीत पाणी शिरते व अ या ठिकाणी पाण्यात शिरलेल्या धातूच्या कणांचेप्रमाण फटीतील प्रमाणापेक्षा वाढते आणि विद्युत् घट तयार होतो व गंजण्याची क्रिया सुरू होते. पाणी नेण्यासाठी बसवलेल्या लोखंडीनळामधील दोन जागी विरघळलेल्या वायूचे प्रमाण वेगवेगळे असेल, तर तेथे विद्युत्घट तयार होतो व गंजण्याची क्रिया सुरू होते.
(ई) विषम धातूंच्या जोडातील गंजणे : दोन निरनिराळ्या धातूंच्या पट्ट्यांचा सांधा केला, तर त्यांच्या विद्युत् वर्चसातील फरकामुळे विद्युत् घट तयार होतो व अनुकूल परिस्थितीत विद्युत् प्रवाह सुरू होतो आणि सांधा गंजू लागतो.
(उ) अंतर्गत गंजणे : धातूचे स्फटिक आणि त्यांच्यामधील सूक्ष्म सीमा यांच्या विद्युत् वर्चसांमध्ये फरक पडला, तर विद्युत् घट उत्पन्न होऊन विद्युत् प्रवाह सुरू होतो व धातूचा अंतर्भाग गंजू लागतो व तेथे धातूचा भुगा तयार होतो.
(ऊ) प्रतिबलामुळे गंजणे : धातूमध्ये कोणत्याही कारणाने प्रतिबल उत्पन्न झालेले असेल, तर स्फटिकांमधील फरकामुळे विद्युत् घट तयार होतो व विद्युत् प्रवाह सुरू होऊन धातू गंजते. धातूच्या पत्र्यातून खोलगट वस्तू तयार करण्याच्या दाबक्रियेमुळे पत्र्यातील निरनिराळ्या ठिकाणी निरनिराळे प्रतिबल उत्पन्न होते. पितळेच्या किंवा अगंज (स्टेनलेस) पोलादी पत्र्याच्या वाटयांचे काठ या कारणाने गंजतात.
(ए) मिश्रधातूमधील एक घटक काही वेळा गंजून नष्ट होतो. पितळातील जस्त व ओतीव लोखंडातील शुद्ध लोखंड ही अनुक्रमे तांबे आणि ग्रॅफाइट यांना धनाग्री असतात. त्यामुळे काही प्रसंगी या धातूही गंजतात.
(ऐ) झिजून गंजणे : कित्येक धातूंचा पृष्ठभाग गंजू नये म्हणून त्यावर गंजण्याच्या क्रियेनेच पातळ गंज प्रतिबंधक आवरण उत्पन्न केलेले, असते. हे आवरण घर्षणामुळे निघून गेले, तर ती जागा पुन्हा जोराने गंजू लागते. ज्या पृष्ठभागावरून उच्चवेगाचे किंवा क्षुब्ध (खळबळणारे) गरम प्रवाह वाहतात तेथे अशा प्रकारचे गंजणे सुरू होते. पंपातील भाग, झडपा आणि उष्णता विनिमयकातील (जास्त तापमानाच्या द्रवातील वा वायूतील उष्णता कमी तापमानाच्या द्रवाला वा वायूला पुरविणाऱ्या साधनातील) नळ्या याच कारणाने गंजून निकामी होतात. याप्रकारात घर्षण वगंजणे या दोन्हीक्रिया एकमेकींना साहाय्य करून झिजण्याची क्रिया अधिक वेगाने चालू ठेवतात.
वायवीय गंजणे : धातू आणि तिच्या परिसरातील वायू यांमधील रासायनिक विक्रियेमुळे धातूच्या पृष्ठभागाचा क्षय होतो व उरलेल्या धातूचे गुणधर्म बदलतात. वायवीय गंजण्याने उत्पन्न झालेला पदार्थ धातूच्या पृष्ठावरच राहतो व काही वेळी त्याचा गंजप्रतिबंधकासारखा उपयोग होतो व रासायनिक विक्रिया क्षीण होते.
वायवीय गंजण्यामुळे पुढील एक किंवा अधिक परिणाम होऊ शकतात : (अ) परिसरातील वायूचे रेणू, अणू व आयन धातूमध्ये विरघळून आत शिरतात व नंतर सर्व धातूमध्ये पसरतात. (आ) धातूच्या पुष्ठभागावर घन पदार्थाचा थर बसतो. (इ) बाष्परूपी नवा पदार्थ तयार होतो. (ई) द्रवरूपी नवा पदार्थ तयार होतो. याक्रियेत उत्पन्न झालेला घन पदार्थ धातूवर घट्ट बसत नसेल अथवा द्रवरूपी अथवा बाष्परूवी पदार्थ तयार होत असेल, तर गंजण्याची क्रिया झपाट्याने होते. साध्या वातावरणात २५° से. तापमान असताना सोने सोडून बाकीच्या सर्व धातूंवर ऑक्सिजनाची विक्रिया होते. बहुतेक सर्व धातूंवर हॅलोजन वायू आणि गंधक यांची विक्रिया होते. कित्येक धातूंवर नायट्रोजन आणि हायड्रोजन यांचीही विक्रिया होते. पाण्याची वाफ, कार्बन डाय-ऑक्साइड, सल्फर डाय-ऑक्साइड आणि इतर वायू मिश्रणे यांचा सामान्य धातूवर होणारा परिणाम सूक्ष्म असतो.
जेट एंजिन व वायू टरबाईन यांमध्ये वापरलेल्या धातूवर उच्चतापमानाचे विविध वायू जोराने आपटतात. त्यामुळे धातूचे क्षरण होऊन खड्डे पडतात व ते भाग गंजून निकामी होतात.
गंजण्याचे मापन करण्याच्या पद्धती: गंजण्याचा क्रियेत धातू नष्ठ होत असल्याने काळाबरोबर धातूचे वजन किती कमी होते, ते पाहून गंजण्याचा वेग ठरविला जातो. धातूचे ठरावीक आकारमानाचे तुकडे निरनिराळ्या परिस्थितीत ठेवून ठरावीक काळानंतर त्यांचे वजन करतात व त्यांचे आलेख काढून ठेवतात. त्याशिवाय त्या तुकड्यांची क्ष-किरणाने सूक्ष्म संरचना व मांडणी तपासून आणि रासायनिक पृथक्करण करूनही त्यांचे परीक्षण करतात.
गंजण्याची क्रिया मोजण्यासाठी (१) प्रयोगशाळा, (२) नैसर्गिक परिस्थिती व(३) औद्योगिक परिस्थिती असे तीन विभाग करतात. प्रयोगशाळेत धातूची बाह्यपरिस्थिती पाहिजे तशी बदलता येते व गंजण्याचा वेग वाढविता येतो. प्रयोगशाळेतील परीक्षण मुख्यत्वेकरून मूलभूत संशोधनासाठी, नव्या मिश्रधातूचे गंजणे पाहण्यासाठी व मानक (प्रमाणभूत, स्टँडर्ड) मूल्यमापन करण्यासाठी असते. मूल्यमापनासाठी खाऱ्या पाण्याच्या फवाऱ्याची पद्धत वापरतात. प्रयोगशाळेतील परीक्षणामुळे बरीच मौलिक माहिती मिळते, परंतु प्रत्यक्ष परिस्थितीमधील गंजण्याच्या क्रियेबद्दल अचूक माहिती मिळत नाही. त्यासाठी धातूचा नमुना प्रत्यक्षपरिस्थितीत ठेवूनच त्याचे परीक्षण करावे लागते. नैसर्गिक परिस्थितीतील गंजण्याची क्रिया म्हणजे पूल, बांधकाम, जहाजे, पाणी वाहून नेणारे नळ वगैरे ठिकाणी होणारी गंजण्याची क्रिया होय. औद्योगिक परिस्थितीतील गंजणे म्हणजे कारखान्यातील यंत्रभाग, रसायने ठेवण्याची भांडी वगैरेंची गंजण्याची क्रिया होय.
गंजण्यावरील प्रतिबंधक उपाय: (१) मौल्यवान किंवा उच्च प्रकारच्या धातूचा वापर, अशा धातूमध्ये सर्व भागात एकसारखे विद्युत् वर्चस् असते. त्यामुळे अंतर्गत भागात विद्युत् घट तयारच होत नाही.
(२) विद्युत् प्रवाहाच्या मार्गात अडथळा ठेवणे. गंजणाऱ्या धातूवर न गंजणाऱ्या पदार्थाचा मुलामा बसविला, तर विद्युत् घट सहज निर्माण होत नाहीत.
(३) बाह्यसाधनाने धातूकडे विद्युत् प्रवाह पाठविणे. यालाच ऋणाग्री संरक्षण म्हणतात.
वर दिलेल्या पहिल्या पहिल्या पद्धतीसाठी मौल्यवान धातू अतिशुध्द धातू व निरनिराळ्या मिश्रधातू असे तीन प्रकार आहेत. यांपैकी पहिल्या दोन प्रकारच्या धातू गंजत नसल्या, तरी त्या फार महाग अससात. म्हणून तिसरा प्रकार गंजण्याच्या दृष्टीने महत्त्वाचा आहे. अशा मिश्रधातूंमध्ये अगंज पोलाद, तांब्याच्या मिश्रधातू, ॲल्युमिनियमाच्या मिश्रधातू व निकेलाच्या मिश्रधातू या विशेष उपयोगी पडतात. साध्या पोलादामध्ये क्रोमियम मिसळले, तर त्या मिश्रधातूच्या गुळगुळीत पृष्ठभागावर ऑक्साइडाचा अतिसूक्ष्म पापुद्रा उत्पन्न होतो व तो गंजप्रतिबंधक असतो. क्रोमियमाप्रमाणे पोलादामध्ये निकेल, मॉलिब्डेनम, टिटॅनियम अशा धातू मिसळून अगंज पोलाद तयार करता येते. घरगुती भांड्यांसाठी वापरीत असलेल्या अगंज पोलादात १८ टक्के क्रोमियम व ८ टक्के निकेल मिसळलेले असते. तांबे आणि तांब्याच्या मिश्रधातू सामान्य वातावरणात गंजत नाहीत व या धातूंवर यांत्रिक प्रक्रिया करणे सोपे जाते, त्यामुळे घरगुती भांडी, समुद्राच्या पाण्याशी संबंध येणारे जहाजातील भाग वगैरेंसाठी या धातूंचा चांगला उपयोग होतो. ॲल्युमिनियम आणि त्याच्या मिश्रधातू याही साधारण वातावरणात गंजत नाहीत. या धातूंच्या पृष्ठभागावर ॲल्युमिनियम ऑक्साइडाचा थर उत्पन्न होतो तो गंजप्रतिबंधक असतो. ॲल्युमिनियमाच्या मिश्रधातू हलक्या,स्वस्त व मजबूत असल्याने विमानातील भागांसाठी त्यांचा चांगला उपयोग होतो. निकेल व तिच्या मिश्रधातू यांची गंजप्रतिबंधक शक्ती फार चांगली असते. त्यामुळे या मिश्रधातू उद्योगधंद्यामध्ये मोठ्या प्रमाणावर वापरल्या जातात.
ज्या ठिकाणीवरील मौल्यवान मिश्रधातू वापरणे परवडत नाही तेथे साध्या पोलादावर गंजप्रतिबंधक पदार्थाचा मुलामा चढवून काम भागविता येते. या मुलाम्यामुळे विद्युत् घट उत्पन्न होत नाहीत परंतु हा मुलामा जर फाटला, तर पुन्हा विद्युत्गट तयार होतात व गंजण्याची क्रिया सुरू होते. म्हणून पोलादाचे आयुष्य वाढविण्यासाठी त्याच्यावर बसविण्याच्या गंजप्रतिबंधक मुलाम्याची जाडी वाढवावी लागते.
गंजप्रतिबंधक मुलाम्यांसाठी वापरण्यात येणाऱ्या पदार्थांचे पुढील प्रकार आहेत : (१) धातवीय : जस्त, कथिल, ॲल्युमिनियम, निकेल,क्रोमियम व तांबे. (२) अकार्बनी : क्रोमेटे, फॉस्फेटे वगैरे अकार्बनी संयुगे. (३) कार्बनी : तैल रंग, डांबर, व्हार्निश, ग्रीज वगैरे पदार्थ.
पोलादी वस्तूवर धातूचा मुलामा बसविण्यासाठी अनेक पद्धती वापरता येतात. त्या कोष्टक क. २ मध्ये दिल्या आहेत.
अकार्बनी प्रकारात धातूची वस्तू अकार्बनी रासायनिक विद्रावात बुडवून काढतात. रासायनिक विद्रावाची विक्रिया धातूच्या सर्वांत वरील थराशी होऊन धातूच्या संयुगाचा एक पातळ थर वस्तूवर तयार होतो, तो गंजप्रतिबंधक असतो.
कार्बनी प्रकारात धातूवर कार्बनी रसायनाचा लेप देणे हा गंज प्रतिबंधनाचा महत्त्वाचा व सहज वापरता येणारा उपाय आहे. यामधील प्रमुख रसायन म्हणजे जवसाचे तेल हे आहे. लेप लावण्यासाठी या तेलात एखादे रंगद्रव्य व काही साहाय्यक पदार्थही मिसळतात. तैल रंगशिवाय धातूच्या साध्या वस्तूवर डांबर लावणे व पत्र्यावर प्लॅस्टिकाचे किंवा रबराचे आवरण बसविणे अशा काही इतर पद्धतीही वापरात आहेत. ज्यावेळी पोलादाची वस्तू साठवून ठेवावयाची असते तेव्हा तिच्या पृष्ठभागावर ग्रीज किंवा तेल लावून ठेवणे म्हणजे तिचे तात्पुरते संरक्षण होते [→धातूंचे मुलामे] .
कोष्टक क्र. २. पोलादी वस्तूवर धातूचा मुलामा बसविण्याच्या पद्धती
| मुलामा बसविण्याच्या पद्धती | मुलाम्याची धातू |
| वितळलेल्या धातूमध्ये बुडवून काढणे | जस्त, कथिल,ॲल्युमिनियम |
| उच्च तापमानावर राखलेल्या धातूच्या चूर्णात खुपसून ठेवणे | जस्त क्रोमियम |
| द्रव धातूचा फवारा मारणे | न गंजणाऱ्या बहुतेक सर्व धातू |
| विद्युत् विलेपण | तांबे, जस्त, कथिल, निकेल, क्रोमियम |
| पत्र्याचे आवरण बसविणे | न गंजणाऱ्या बहुतेक सर्व धातू |
गंज प्रतिबंधाच्या विद्युत् पद्धतीत सुरक्षित ठेवण्याची वस्तू जर कृत्रिम रीतीने ऋणाग्र केली, तर तिचे गंजणे टाळता येते. मॅग्नेशियम ही धातू लोखंडापेक्षा पुष्कळच धनाग्री आहे. या धातूची पट्टी जमिनीत पुरून तिचा व लोखंडी नळाचा विद्युत् संवाहकाने संबंध जोडला, तर या दोघांमध्ये विद्युत् घट उत्पन्न होतो व गंजण्याचा उपद्रव मॅग्नेशियमावर जातो आणि लोखंडी नळाचे संरक्षण होते. काही ठिकाणी संरक्षण करण्याच्या वस्तूपासून काही अंतरावर एक विद्युत् घटच ठेवतात व त्यातील ऋणाग्रातून निघणारा विद्युत् प्रवाह संरक्षण करणाच्या वस्तूकडे पाठवितात.
दिल्लीजवळ इ. स. चौथ्या शतकात एक लोखंडी स्तंभ उभारलेला आहे. तो उघड्या जागेत असूनही अजून गंजलेला नाही. या स्तंभातील लोखंडात फॉस्फरस आहे, पण मँगॅनीज आणि गंधक मुळीच नाहीत. त्यामुळेच ते लोखंड गंजरोधक झाले असावे असे दिसते.
संदर्भ :
- Evans, U. R.Introduction to Metallic Corrosion, New York, 1964.
- McKay, R. W. Ivey, D. G. Corrosion Resistance of Metals and Alloys, London, 1964.
- Speller, F. N. Corrosion: Causes and Prevention, London, 1951.
- UhIig, H. H. The Corrosion Handbook, London, 1948.
- Uhlig, H. H. Corrosion and Corrosion Control and Introduction to Corrosion Science and Engineering, New York, 1964.