मॅग्नेशियमाची सर्व संयुगे द्विसंयुजी आहेत आणि ती विपुल प्रमाणात आढळतात.
मॅग्नेशियम कार्बोनेट : (MgCO3). निसर्गात मुख्यतः मॅग्नेपसाइटाच्या स्वरूपात तसेच डोलोमाइड व डोलोमाइटी चुनखडकातही सापडते. मॅग्नेशियम सल्फेटाच्या विद्रावात सोडियम बायकार्बोनेटाचा विद्राव ओतल्यास हे तयार होते. निसर्गात सापडणारे मॅग्नेसाइट हे बरेच अशुद्ध असल्याने आणि ते शुद्ध करण्याच्या पद्धती फायदेशीर नसल्याने याचे उत्पादन मुख्यतः रासायनिक पद्धतीनेच करतात.
गुणधर्म : मॅग्नेशियम कार्बोनेट घनरूप व पांढरे असून ते तापवल्यास उष्णतेमुळे त्याचे अपघटन (रेणूचे तुकडे होण्याची क्रिया) होते आणि मॅग्नेशियम ऑक्साइड (MgO) व कार्बन डायऑक्साइड तयार होतात.
मॅग्नेशियम कार्बोनेटावर सौम्य हायड्रोक्लोरिक अम्लाची विक्रिया केल्यास मॅग्नेशियम क्लोराइड, पाणी व कार्बन डाय-ऑक्साइड तयार होतात.
उपयोग : मॅग्नेशियम कार्बोनेटाचा उच्च तापसह (उच्च तापमानाला न वितळता टिकून राहणारा) पदार्थ म्हणून, तसेच मृत्तिकाशिल्प, काच, खते, रबर, शाई, रंग, औषधे, सौंदर्यप्रसाधने इ. धंद्यांत उपयोग होतो. औषधनिर्मितीत चूर्णाचे आकारमान वाढविण्याकरिता, तसेच मॅग्नेशियम सायट्रेट व इतर काही संयुगे तयार करण्यासाठी याचा उपयोग केला जातो.
मॅग्नेशियम क्लोराइड : (MgCl2). हे निसर्गात कार्नालाइट या खनिजाच्या रूपात (KCI·MgCl2·6H2O) तसेच समुद्राच्या पाण्यात आढळते.
गुणधर्म : हे पांढरे व घनरूप असून याचे वि. गु. २·३ व वितळबिंदू ७०८° से. आहे. ते चिघळणारे (हवेतील आर्द्रता शोषून घेणारे) आहे.
समुद्राच्या पाण्यापासून मॅग्नेशियम क्लोराइड तयार करण्याच्या पद्धतीचा अलीकडे मोठ्या प्रमाणात वापर करण्यात येतो. या पद्धतीत प्रथम मॅग्नेशियम हायड्रॉक्साइड मिळते. त्यावर हायड्रोक्लोरिक अम्लाची विक्रिया करून मॅग्नेशियम क्लोराइड मिळते. त्याचे स्फटिक तयार करतात. या स्फटिकांचे सूत्र MgCl2·6H2O असे आहे. ते पाण्यात बरेच विद्राव्य (विरघळणारे) आहे, तर मिथेनॉल व एथॅनॉल यांमध्ये अल्प प्रमाणात विद्राव्य आहे. मॅग्नेशियम क्लोराइडातील स्फटिकजल नुसते तापवून घालवता येत नाही, कारण त्याचे ऑक्सिक्लोराइडात व शेवटी ऑक्साइडात रूपांतर होते.
मॅग्नेशियम क्लोराइड निर्जल करण्याच्या निरनिराळ्या पद्धती आहेत. सर्वांत महत्त्वाची म्हणजे दोन टप्प्यांत निर्जलीकरण करणे. पहिल्या टप्प्यात बाष्पीभवनाने स्फटिकजलाचे चार रेणू घालवतात व उरलेले दोन रेणू हायड्रोजन क्लोराइड किंवा क्लोरीन वायूच्या वातावरणात बाष्पीभवन करून घालवतात. संहत (विद्रावात जास्त प्रमाणात असलेल्या) मॅग्नेशियम क्लोराइडामध्ये भाजलेला मॅग्नेशिया (मॅग्नेशियम ऑक्साइड) घालून त्याची रबडी तयार केल्यास ते मिश्रण दगडासारखे कठीण होते. या मिश्रणास ‘सॉरेल सिमेंट’ किंवा ऑक्सिक्लोराइड सिमेंट असे म्हणतात. यापासून कृत्रिम दगड, फरश्या तयार करता येतात, तसेच जमिनीसाठी व गिलाव्यासाठीही हे वापरतात.
उपयोग : मॅग्नेशियम क्लोराइडाचा उपयोग मुख्यतः मॅग्नेशियम धातुनिर्मितीसाठी तसेच न गोठणारी मिश्रणे बनविण्याकरिता व ऑक्सिक्लोराइड सिमेंट तयार करण्याकरिता करतात.
मॅग्नेशियम ऑक्साइड : (MgO). मॅग्नेशियम धातू ऑक्सिजनाच्या वातावरणात तापवून किंवा मॅग्नेशियम कार्बोनेट अगर मॅग्नेशियम हायड्रॉक्साइड अथवा मॅग्नेसाइट उच्च तापमानाला तापवून मॅग्नेशियम ऑक्साइड मिळवतात. याला ‘मॅग्नेशिया’ म्हणतात.
गुणधर्म : कच्चा माल, तापमान व वेळ यांवर मॅग्नेशियाची प्रत अवलंबून असते. १,६५०° से. तापमानाला तयार केलेल्या मॅग्नेशियाला ‘डेडबर्न्ट’ मॅग्नेशिया म्हणतात. याचा वितळबिंदू २,८००° से. आहे. त्यामुळे त्याच्या उच्चतापसह विटा बनवितात य त्या निरनिराळ्या उच्च तापमान विद्युत् भट्ट्यांना आतून अस्तरासाठी वापरतात.
उपयोग : मॅग्नेशियम ऑक्साइड मॅग्नेशियम धातू तयार करण्यासाठी, रबर, औषधे, सौंदर्यप्रसाधने, ऑक्सिक्लोराइड सिमेंट, कागद, खते, कापडावरील संस्करण, अग्निरोधन इ. उद्योगांत वापरतात. शुद्ध मॅग्नेशिया मॅग्नेशियम संयुगे तयार करण्यासाठी व निर्जल धुलाईच्या कामात विद्रावकाचे (विरघळविणाऱ्या पदार्थाचे) रंग काढण्यासाठी वापरला जातो.
मॅग्नेशियम हायड्रॉक्साइड : [Mg (OH)2]. गाळून घेतलेल्या समुद्राच्या पाण्यात चुन्याची निवळी घातल्यास हे तयार होते.
गुणधर्म : हे पांढरे असून याचे वि. गु. २·३६ असते. ३५° से. पर्यंत तापवल्यास याचे अपघटन होते व मॅग्नेशियम ऑक्साइड तयार होते.
उपयोग : याचा उपयोग औषधांमध्ये अम्लनाशक म्हणून व सौम्य रेचक म्हणून होतो. ‘मिल्क ऑफ मॅग्नेशिया’ या नावाने द्रव स्थितीत व वड्यांच्या (गोळ्यांच्या) स्वरूपात हे विकले जाते. टूथपेस्टमध्येही याचा उपयोग होतो.
मॅग्नेशियम सल्फेट : (MgSO4). हे कीसेराइट (MgSO4· H2O), तसेच एप्सम सॉल्ट (MgSO4·7H2O) या स्वरूपात आढळते. मॅग्नेशियम ऑक्साइड, हायड्रॉक्साइड आणि कार्बोनेट यांच्यावर सल्फ्युरिक अम्लाची विक्रिया केल्यास हे मिळते.
गुणधर्म : हे पांढरे असून याचे वि. गु. २·६६ आहे. हे पाण्यात विरघळते. याचे जलीय विच्छेदनही (पाण्यामुळे रेणूचे तुकडे होण्याची क्रिया) अल्प प्रमाणात होते. एप्सम सॉल्ट २५०° से. पर्यंत तापविल्यास निर्जल मॅग्नेशियम सल्फेट तयार होते व पुढे ६००° से. पर्यंत तापविल्यास त्याचे अपघटन होऊन मॅग्नेशियम ऑक्साइड आणि सल्फर ट्राय-ऑक्साइड तयार होतात.
उपयोग : याचा उपयोग सिमेंट तयार करण्याकरिता, खते तयार करण्यासाठी, कातडी कमवण्याच्या कृतीमध्ये तसेच रेचक म्हणून औषधामध्ये होतो. शिवाय कागद, कापड, स्फोटके, आगपेट्या,पशुखाद्य इ. उद्योगांतही हे वापरतात. वनस्पतींतील हरितद्रव्यात मॅग्नेशियम हा एक घटक आहे, मॅग्नेशियमाच्या खतांतून वनस्पतींना हरितद्रव्य निर्मितीसाठी मॅग्नेशियम मिळते.
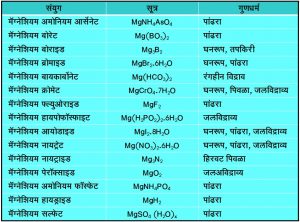
मॅग्नेशियमाच्या इतर काही अकार्बनी संयुगांची नावे, त्यांची सूत्रे व गुणधर्म मागील कोष्टकात दिले आहेत.
कार्बनी संयुगे : मॅग्नेशियमाची ॲसिटेट [ Mg3(C2H3O2 )2·4H2O], सायट्रेट [Mg3(C6H5O7)2·4H2O], लॅक्टेट [Mg(C3H5O3)2·3H2O], सॅलिसिलेट [Mg(C7H5O3)2·4H2O], ओलिएट [Mg(C18H33O2)2] इ. कार्बनी संयुगे तयार होतात. यांपैकी शेवटचे संयुग पाण्यात न विरघळणारे व पिवळे असून इतर संयुगे पांढरी व पाण्यात विरघळणारी आहेत.
ग्रीन्यार विक्रियाकारक : मॅग्नेशियमाच्या संयुगांपासून पुष्कळदा अमाइने व अमाइन जटिले बनतात, तर अल्किल व अरिल हॅलाइडांशी मॅग्नेशियमाची विक्रिया होऊन ग्रीन्यार विक्रियाकारक बनतात. ही याची महत्त्वाची कार्बनी संयुगे असून त्यांचे सूत्र RMgX (R = अल्किल गट, X = हॅलोजन) असे आहे. उदा.,
Mg + C2H5I → C2H5MgI
या संयुगांचा उपयोग सिलिकोनांसारख्या अनेक कार्बनी संयुगांच्या संश्लेषणात होतो.




