
इटर्बियम हे विरल मृत्तिका गटातील एक धातुरूप मूलद्रव्य आहे. याची रासायनिक संज्ञा Yb असून अणुक्रमांक ७० आणि अणुभार १७३·०४ इतका आहे.
इतिहास : जे. सी. जी. मारीन्याक यांना १८७८ साली इटर्बी (स्वीडन) येथे आढळलेल्या मातीत इटर्बियम जास्त प्रमाणात असल्याचे प्रथम दिसून आले. त्यांनी त्या मातीला इटर्बी गावाचे नाव दिले. नंतर १९०७-०८ साली जी. यूर्बी व ए. सी. फोन वेल्सबाख यांनी स्वतंत्रपणे असे दाखवून दिले की, मारीन्याक यांना सापडलेली माती म्हणजे दोन ऑक्साइडांचे मिश्रण आहे. त्या ऑक्साइडांना यूर्बी यांनी ल्युटेशिया व इटर्बिया आणि त्याच्यातील धातूंना ल्युटेशियम व निओइटर्बियम अशी नावे दिली. निओइटर्बियमाचेच पुढे इटर्बियम झाले. कधीकधी इटर्बियमाला अल्डेबेरॅनियम असेही म्हणतात.
आढळ : इटर्बियम हे अतिशय विरल असे मूलद्रव्य असून विरल मृत्तिकांनी युक्त अशा गॅडोलिनाइट, ब्लोमस्ट्रांडाइन, समर्स्काइट इत्यादींसारख्या खनिजांत ते अत्यल्प प्रमाणात आढळते.
प्राप्ती : द्विसंयुजी अवस्थेतील इटर्बियम इतर विरल मृत्तिकांपासून सहज वेगळे काढता येते. सोडियम पारदमेलाने (Sodium amalgam) प्रथम क्षपण आणि नंतर शोषण करून इटर्बियम इतर विरल मृत्तिकांपासून वेगळे करतात. ही पद्धती जे. के. मार्श यांनी १९४२ मध्ये शोधून काढली. आयन विनिमय (Ion exchange) तंत्राने त्रिसंयुजी अवस्थेतील इटर्बियम इतरांपासून वेगळे करता येते.
ऊर्ध्वपातनाने (Distillation) इटर्बियम धातू मिळविण्याची पद्धती सर्वांत चांगली आहे. या पद्धतीमध्ये Yb2O3 या ऑक्साइडाचे लँथॅनम धातुबरोबर ऊष्मीय क्षपण करण्यात येते. नंतर निर्वात ऊर्ध्वपातन करून बाहेर पडणारा शुद्ध इटर्बियम धातू मिळवला जातो, कारण इटर्बियम हा बाष्पनशील विरल मृत्तिकांपैकी एक आहे.
इटर्बियमाच्या निर्जलीय हॅलाइडांचे (क्लोराइड, ब्रोमाइड इ.) क्षार (Alkali) किंवा क्षारीय धातू (सोडियम, पोटॅशियम, लिथियम इ.) यांच्याद्वारे ऊष्मीय क्षपण करूनही शुद्ध इटर्बियम धातू तयार करतात.
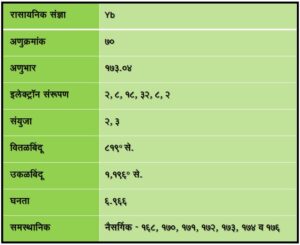
भौतिक गुणधर्म : इटर्बियम हा धातू रुपेरी व मऊ असतो. या मूलद्रव्याचे विरल मृत्तिका गटातील मूलद्रव्यांपेक्षा (Rare earth elements) कॅल्शियम-स्ट्राँशियम-बेरियम या श्रेणीशी अधिक साम्य असल्याचे दिसून येते. इटर्बियम पाण्यात हळूहळू विरघळतो, परंतु अम्लांमध्ये सहज विद्राव्य आहे.
रासायनिक गुणधर्म : इटर्बियमाचे हवेत हळूहळू ऑक्सिडीकरण होते, त्यामुळे तो काळवंडतो.
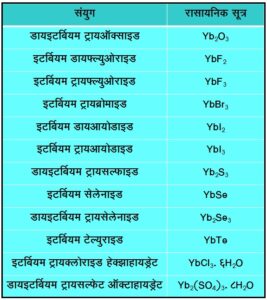
संयुगे : इटर्बियम ऑक्साइड : (Yb2O3). इटर्बियमचे हे सामान्य ऑक्साइड वर्णहीन असून ते अम्लामध्ये सहज विरघळते. या ऑक्साइडापासून त्रिसंयुजी, वर्णहीन व समकर्षुकीय (Isomagnetic) लवणांचे विद्राव मिळतात. याची द्विसंयुजी संयुगेही असतात.
इटर्बियम (II) क्लोराइड : (YbCl2). डब्ल्यू. क्लेम (W. Klemm) व डब्ल्यू. शूथ (W. Schuth) यांनी त्रिसंयुजी संयुगाचे हायड्रोजनाने क्षपण करून द्विसंयुजी संयुग मिळविले (१९२९).
2 YbCl3 + H2 → YbCl2 + 2 HCl
इटर्बियम (III) क्लोराइड : (YbCl3). इटर्बियम ऑक्साइडासोबत कार्बन टेट्राक्लाराइड किंवा हायड्रोक्लोरिक अम्ल यांची रासायनिक विक्रिया झाली असता इटर्बियम (III) क्लोराइड तयार होते.
2 Yb2O3 + 3 CCl4 (g) → 4 YbCl3 (s) + 3 CO2 (g)
Yb2O3 + 6 HCl (g) → 2 YbCl3 (s) + 3 H2O
इटर्बियम (III) क्लोराइडाचा उपयोग विविध रासायनिक विक्रियांमध्ये उत्प्रेरक (Catalyst) म्हणून केला जातो.
इटर्बियमाच्या त्रिसंयुजी संयुगांच्या विद्युत् विच्छेदी क्षपणानेही द्विसंयुजी संयुगे तयार करता येतात व ती अतिशय शुद्ध स्वरूपात मिळू शकतात. तसेच त्रिसंयुजी लवणाची सोडियम पारदमेलाशी विक्रिया घडवून आणून Yb+2 हे आयन मिळविता येते. हे आयन फिकट हिरव्या रंगाचे असते.
YbSO4, YbCl2, YbBr2, Yb(OH)2 व YbCO3 ही द्विसंयुजी संयुगेही फिकट हिरवी असतात. Yb+2 हे आयन जलीय विद्रावात अगदी अस्थिर असल्यामुळे पाण्याचे जलद क्षपण होऊन हायड्रोजन मुक्त होतो.
त्रिसंयुजी अवस्थेतील इटर्बियमाचे गुणधर्म विरल मृत्तिकांच्या गुणधर्माशी जुळणारे असे असतात. त्याची Yb2O3, Yb2(SO4)3 व YbCl3 ही त्रिसंयुजी लवणे पांढरी आहेत. Yb+3 हे आयन वर्णहीन असते.
उपयोग : लेसर निर्मितीमध्ये तसेच काही औद्योगिक विक्रियांमध्ये उत्प्रेरक म्हणून इटर्बियमचा वापर होतो.
पहा : विरल मृत्तिका.
संदर्भ :
- Hampel, C. A. Rare Metals Handbook, London,
- https://www.britannica.com/science/ytterbium
- https://www.webelements.com/ytterbium/compounds.html
- https://www.rsc.org/periodic-table/element/70/ytterbium




